發布日期 (HKT) 2022-06-08
相關研究的對象不是復必泰新冠疫苗, 不能證明「接種復必泰疫苗會導致體內淋巴細胞數量下降」
圖一:Facebook帖文截圖
(*點擊查看大圖)
經查核:
一、BNT162b1和BNT162b2為德國BioNTech和美國輝瑞公司開發的兩款候選新冠疫苗。其中,BNT162b1疫苗的研發已於2020年11月中止,至今未上市;BNT162b2疫苗即為復必泰疫苗,於2020年12月31日被世界衞生組織納入緊急使用清單,2021年8月23日正式獲得美國食品及藥物管理局批准。
二、原帖文引用了一篇發表在《自然》期刊的論文。該論文的研究對象是未上市的候選疫苗BNT162b1,而非復必泰疫苗(BNT162b2)。因此,該研究沒有證實接種復必泰新冠疫苗會導致體內淋巴細胞數量下降。
結果判定
相關研究的對象不是復必泰新冠疫苗,不能證明「接種復必泰疫苗會導致體內淋巴細胞數量下降」。
背景
有Facebook用戶於2022年4月16日發布帖文稱,「打BNT162B2(復必泰)是否會增強抵抗力呢?根據Phase I/II study of COVID-19 RNA vaccine BNT162b1 in adults的報告指出,打完BNT162B2後,身體的淋巴球(白血球的一種)有下降⋯⋯」。淋巴球,即淋巴細胞,是一類具有免疫識別功能的細胞,能夠瞄準特定的病原體。該Facebook帖文意指接種復必泰新冠疫苗會造成淋巴細胞數量下降,降低人體抵抗力。
至截稿時,該帖文被分享68次,收到8個回應及274個讚好或心情。
查核
原帖文提到的兩個疫苗代號BNT162b1(下文簡稱b1)和BNT162b2(下文簡稱b2),所指的是德國BioNTech和美國輝瑞公司開發的兩款候選新冠疫苗,兩款疫苗都採用了信使核糖核酸(mRNA)技術。基於研發階段的數據,b1疫苗的研發已在2020年11月中止。世界衞生組織於2020年12月31日將b2疫苗,即商品名為復必泰的新冠疫苗納入緊急使用清單。美國食品及藥物管理局(FDA)於2020年12月11日緊急批准使用復必泰新冠疫苗,並於2021年8月23日正式批准復必泰疫苗用於預防16歲或以上人群感染新冠肺炎。根據本港的《預防及控制疾病(使用疫苗)規例》(第599K章),食物及衞生局局長於2021年1月25日認可復必泰新冠疫苗在香港作緊急使用。
圖二:復必泰疫苗批准文件截圖
(*點擊查看大圖)
原帖文引用一篇於2020年8月12日發布在《自然》(Nature)期刊的論文,題為《針對成人的RNA新冠疫苗BNT162b1第一、二期臨床研究》(Phase I/II study of COVID-19 RNA vaccine BNT162b1 in adults)。該論文的研究對象為b1疫苗,並非已上市的b2疫苗(即復必泰疫苗)。原帖文多次混淆b1疫苗和b2疫苗,以未上市的候選疫苗b1的相關研究,得出了「已上市的b2疫苗對人體有害」的錯誤結論。
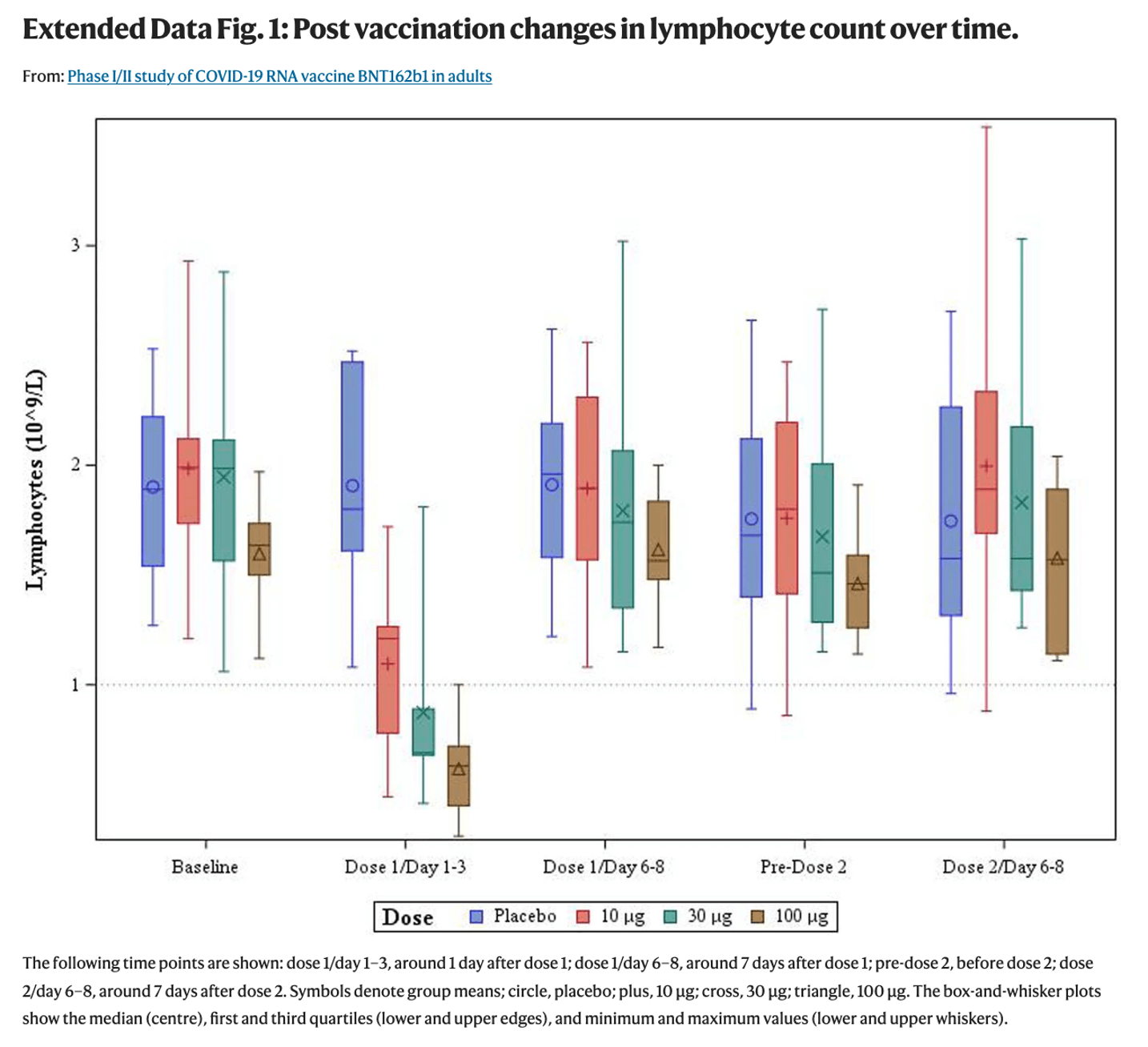
另外,雖然研究中部分參與者在接種b1疫苗後出現了淋巴細胞數量降低的情況,但論文認為,淋巴細胞數量下降是暫時性的:在接種第一劑疫苗後約1天,部分參與者的淋巴細胞數量下降,但在接種第一劑疫苗後6至8天,所有人的淋巴細胞數量均回復到正常值。
圖三:《自然》期刊的論文中有關接種疫苗後淋巴細胞數量變化的圖表
(*點擊查看大圖)
結論
相關研究的對象不是復必泰新冠疫苗,不能證明「接種復必泰疫苗會導致體內淋巴細胞數量下降」。
參考資料
- Facebook帖文
- 《新英格蘭醫學雜誌》「Safety and Immunogenicity of Two RNA-Based Covid-19 Vaccine Candidates」
- Reuters:「China’s Fosun to end BioNTech’s COVID-19 vaccine trial, seek approval for another」
- 美國食品及藥物管理局:「Comirnaty and Pfizer-BioNTech COVID-19 Vaccine」
- 電子版香港法例:《預防及控制疾病(使用疫苗)規例》
- 香港特別行政區政府新聞公報:《食物及衞生局局長認可復星醫藥/德國藥廠BioNTech的新冠疫苗在香港作緊急使用》
- 食物及衞生局:《預防及控制疾病(使用疫苗)規例》(第599K章)下認可疫苗的審批
- 世界衞生組織:「WHO issues its first emergency use validation for a COVID-19 vaccine and emphasizes need for equitable global access」
- 《自然》:「Phase I/II study of COVID-19 RNA vaccine BNT162b1 in adults」
| Hot Topic |
|---|
| 查核 |














 :
: